A. TỔNG QUAN ÔN TẬP ĐỀ THI HÓA LỚP 9 HỌC KÌ 1
I. Lý thuyết:
Tính chất hóa học của những chất: oxit, axit, muối, bazơ, kim loại, phi kim.
Bạn đang xem: Đề cương ôn thi hóa lớp 9 học kì 1
Tính chất hóa học của những chất: axit sunfuric đặc, nhôm, clo.
Phân bón hóa học.
Các biện pháp để phòng chống ăn mòn kim loại.
Dãy hoạt động hóa học của những hợp chất kim loại và ý nghĩa của nó.
Tính chất vật lý của Ca
O, Na
OH, Al, SO2, H2SO4, Fe, Cl2.
Điều chế: SO2 , Na
OH, Ca
O, H2SO4, Al, Cl2.
Ứng dụng của Ca
O, Al, Na
Cl, Fe (thép – gang)
Điều kiện để phản ứng có thể xảy ra ở trong dung dịch.
Lưu ý học lại về tính tan và xem các hiện tượng xảy ra ở trong các thí nghiệm trong sách giáo khoa, màu sắc của các chất, các hợp chất, các dung dịch ta đã biết.
II. Các dạng bài tập:
Viết các phương trình hóa học để minh họa cho tính chất hóa học, ứng dụng của các chất, phương trình hóa học để điều chế các chất.
Dựa vào những tính chất hóa học, tính chất vật lý để giải thích những ứng dụng, những hiện tượng chúng ta thường gặp.
Viết phương trình hóa học để hoàn thành những dãy chuyển hóa, thể hiện mối quan hệ tương quan giữa các loại hợp chất vô cơ.
Phân biệt và nhận biết các chất bằng những phương pháp vật lý và hóa học.
Các bài tập định lượng như sau: áp dụng tính theo phương trình hóa học, tính nồng độ dung dịch,định luật bảo toàn khối lượng, tính khối lượng kết tủa, tính thành phần trong hỗn hợp ban đầu hoặc hỗn hợp sản phẩm, tính thể tích chất khí (đktc), xác định tên của nguyên tố….
III. Phần mở rộng:
Áp dụng những kiến thức mở rộng trong phần mục em có biết.
Phản ứng giữa những chất: oxit axit với dung bazơ.
Phản ứng giữa những chất: kim loại với axit sunfuric đặc nóng.
Phản ứng giữa những chất: Al, Zn với dung dịch bazơ.
B. LÝ THUYẾT ĐỀ CƯƠNG ÔN THI HỌC KÌ 1 MÔN HÓA 9
I. OXIT
a) Định nghĩa: Oxit là một hợp chất gồm có 2 nguyên tố, trong đó thì có một nguyên tố là oxi.
Ví dụ: Ca
O, CO, Na2O, Fe3O4, SO2, P2O5, …
b) Tính chất hóa học:

2) Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O
3) Al(NO3)3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4NO3
4) Al(OH)3 + Na
OH → Na
5) K
6) 2Al(OH)3 → 2Al2O3 + 3H2O
7) Al2O3 + 2Na
OH + 3H2O → 2Na
8) 2K
9) Al2(SO4)3 + K2SO4 + 24H2O → 2KAl(SO4)2.12H2O
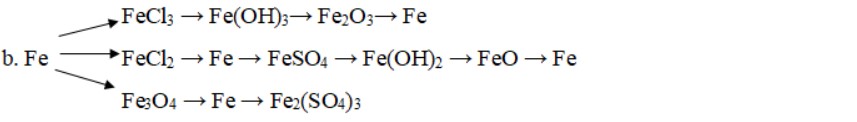
c. Fe
S2 → SO2 → SO3 → H2SO4 → Cu
SO4 → Na2SO4 → Na
OH → Na2Zn
O2.
Hướng dẫn giải bài:
4Fe
S2+ 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2→2SO3
SO3 + H2O → H2SO4
Cu
O + H2SO4 → Cu
SO4+ H2O
Cu
SO4 + 2Na
OH → Cu(OH)2↓+ Na2SO4
Na2SO4 + Ba(OH)2 → Ba
SO4↓+ 2Na
OH
Zn + 2Na
OH → Na2Zn
O2 + H2↑
d. Mg → Mg
SO4 → Mg(OH)2 → Mg
O → Mg
Cl2 → Mg(NO3)2 → Mg
CO3 → Mg
O
Mg + H2SO4 → Mg
SO4 + H2
Mg
SO4 + Na
OH → Mg(OH)2 + Na2SO4
Mg(OH)2 → Mg
O + H2O
Mg
O + 2HCl → Mg
Cl2 + H2O
Mg
Cl2 + 2Ag
NO3 → Mg(NO3)2 + 2Ag
Cl
Mg(NO3)2 + Ca
CO3 → Mg
CO3 + Ca(NO3)2
Mg
CO3 → Mg
O + CO2
Bài 2: Nhận biết các chất (hợp chất) sau bằng những phương pháp hóa học
1. Các chất rắn
a) Ba
O, Mg
O, Cu
O
b) Cu
O, Al, Mg
O, Ag
c) Ca
O, Na2O, Mg
O và P2O5
d) Na2O, Ca
O, Ag2O, Al2O3, Fe2O3, Mn
O2, Cu
O.
e) P2O5, Na2CO3, Na
Cl, Mg
CO3
f) Na
OH, KNO3, Ca
CO3, Mg
O, P2O5, Ba
SO4
a) Ba
O, Mg
O, Cu
O
Trích lần lượt các chất (hợp chất) ra để làm mẫu thử.
Cho hợp chất H2O vào lần lượt từng mẫu thử, mẫu nào tạo ra có thể kết tủa trắng là chất Mg
O, nếu tạo ra kết tủa xanh lơ thì là Cu(OH)2, nếu phản ứng bình thường thì là Ba
O.
Ba
O + H2O → Ba(OH)2
Mg
O + H2O → Mg(OH)2
Cu
O + H2O → Cu(OH)2
b) Cu
O, Al, Mg
O, Ag
Trích dẫn lần lượt các chất ra để làm mẫu thử.
Cho chất H2O vào lần lượt những mẫu thử sau, mẫu thử nào mà xuất hiện kết tủa trắng thì là Mg
O , nếu xuất hiện kết tủa xanh lơ thì là Cu
O, nếu xuất hiện kết tủa keo trắng và có khí bay ra thì là Al, còn nếu không tác dụng được thì là Ag.
Mg
O + H2O → Mg(OH)2
Cu
O + H2O → Cu(OH)2
Al + H2O → Al(OH)3 + H2
c) Ca
O, Na2O, Mg
O và P2O5
Trích mỗi chất (hợp chất) một ít để làm mẫu thử, lần lượt cho các chất (hợp chất) vào trong nước:
+ Chất không tan là chất Mg
O.
+ Chất tan là chất Na2O, Ca
O, và P2O5
Phương trình hóa học:
Na2O + H2O → 2Na
OH
Ca
O + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
Cho giấy quỳ tím vào dung dịch ta thu được:
+ Chất làm quỳ tím hóa đỏ là chất: H3PO4 → chất ban đầu là chất P2O5
+ Chất làm quỳ tím hóa xanh là chất: Na
OH và Ca(OH)2.
Sục khí CO2 qua 2 dung dịch làm cho quỳ tím hóa xanh:
+ Dung dịch có xuất hiện kết tủa trắng là dd Ca(OH)2 → chất ban đầu là chất Ca
O:
Ca(OH)2 + CO2→ Ca
CO3 + H2O
+ Dung dịch không xuất hiện hiện tượng là dd Na
OH → chất ban đầu là chất Na2O:
2Na
OH + CO2 → Na2CO3 + H2O
d) Na2O, Ca
O, Ag2O, Al2O3, Fe2O3, Mn
O2, Cu
O.
Lấy mẫu thử của 8 chất bột vừa rồi, rồi dùng dung dịch HCl đặc để phân biệt:
Mẫu thử nào tan và có xuất hiện kết tủa màu trắng là chất Ag2O
Ag2O + 2HCl → 2Ag
Cl + H2O
Mẫu thử nào tan và có xuất hiện khí màu vàng lục là chất Mn
O2.
Mn
O2 + 4HCl(đặc) → Mn
Cl2+ Cl2+ 2H2O
Mẫu thử nào tan và có xuất hiện dung dịch có màu vàng nâu là chất Fe2O3.
Fe2O3 + 6HCl → 2Fe
Cl3+ 3H2O
Mẫu thử nào tan và có xuất hiện dung dịch có màu xanh là chất Cu
O.
Cu
O + 2HCl → Cu
Cl2 + H2O
Mẫu thử nào tan và có xuất hiện dung dịch không màu là những chất Na2O, Ca
O, Al2O3.
Na2O + 2HCl → 2Na
Cl + H2O
Ca
O + 2HCl → Ca
Cl2 + H2O
Al2O3 + 6HCl → 2Al
Cl3 + 3H2O
Dùng nước có pha dung dịch phenolphtalein vào ba mẫu thử chất bột của các chất Na2O, Ca
O, Al2O3.
Mẫu thử nào mà không tan là chất Al2O3.
Mẫu thử nào tan và làm cho dung dịch phenolphtalein hóa hồng là chất Ca
O, Na2O.
Ca
O + H2O → Ca(OH)2
Na2O + H2O → 2Na
OH
Dùng dung dịch H2SO4 vào dung dịch vừa mới tạo thành của Ca
O, Na2O
Mẫu thử nào có xuất hiện kết tủa trắng thì ban đầu là chất Ca
O.
Ca(OH)2 + H2SO4 → Ca
SO4 + 2H2O
Mẫu thử nào mà không xuất hiện hiện tượng thì ban đầu là chất Na2O.
2. Các dung dịch
a) HNO3, H2SO4, HCl, K2SO4, KNO3, KOH, Ba(OH)2.
b) HCl, Na
OH, Na2SO4, Na
Cl.
c) HCl, H2SO4, Na
Cl, Na2CO3
d) Na
OH, Ba
Cl2, Ba(OH)2, Na
Cl
e) Na2SO4, K2CO3, Ba
Cl2, Ag
NO3
f) KNO3, Cu(NO3)2, Ag
NO3, Fe(NO3)3
3. Các chất khí
a) CO2, H2, N2, CO, O2, Cl2
b) CO, CO2, SO2, SO3, H2
c) CO, CO2, SO2
4. Các kim loại
Al, Fe, Cu, Zn
Bài 3: Bài toán hỗn hợp
Hòa tan 8,9 gam hỗn hợp Zn và Mg một lượng vừa đủ vào dung dịch H2SO4 0,2M, ta thu được dung dịch A và 4,48 lít khí H2 ở đktc.
a. Tính thành phần tỷ lệ % theo khối lượng của mỗi kim loại?
b. Tính thể tích dung dịch axit đã được sử dụng?
Hướng dẫn giải bài:
n
H2= 4,48/22,4 = 0,2 mol
Gọi x, y lần lượt là hai số mol của Mg và Zn.
Phương trình phản ứng xảy ra:
Mg + H2SO4 → Mg
SO4+ H2
x → x → x → x mol
Zn + H2SO4 → Zn
SO4 + H2
y → y → y → y mol
n
H2 = x + y = 0,2 (1)
Mặt khác ta có
24x + 65y = 8,9 (2)
Giải hệ phương trình (1) và (2) ta thu được:
⇒ x = 0,1; y= 0,1
n
Mg = 0,1 mol
m
Mg = 0,1.24 = 2,4
%m
Mg = 2,4.100/8.9 = 26.97%
%m
Zn = 100 – 29,97= 73.03%
b) n
H2SO4 = 0,2 mol
Vdd = 0,2/0,2 = 1 (lít)
Dựa vào những kiến thức và bài tập minh họa bên trên, các em hãy giải những bài tập sau đây:
Câu 1. Cho 27 gam hỗn hợp Al và Zn
O vào trong dung dịch HCl 29,2% (một lượng vừa đủ) thì ta thu được 13,44 lít khí (đktc)
a) Tính % theo khối lượng mỗi chất (hợp chất) ở trong hỗn hợp ban đầu?
b) Tính khối lượng dung dịch HCl cần sử dụng?
c) Tính nồng độ % các muối có ở trong dung dịch thu được sau khi phản ứng?
Câu 2. Dẫn 10 lít hỗn hợp khí SO2 và CO thông qua dung dịch Ba(OH)2 dư. Sau phản ứng ta thu được 81,375 gam kết tủa. Tính thành phần % theo thể tích mỗi khí ở trong hỗn hợp ban đầu? (Biết rằng thể tích các khí đo ở đktc).
Câu 3. Hòa tan hoàn toàn 12,1 gam hỗn hợp bột Zn
O và Cu
O ta cần 73,5 gam dung dịch H2SO4 20%.
a) Viết các phương trình hóa học.
b) Tính phần trăm theo khối lượng của mỗi chất oxit ở trong hỗn hợp ban đầu.
Câu 4. Cho 17,5 gam hỗn hợp gồm có 3 kim loại Zn, Al, Fe hòa tan hoàn toàn ở trong dung dịch H2SO4 0,5M, ta thu được 11,2 lít H2 (đktc). Tính thể tích dung dịch axit tối thiểu mà phải dùng và khối lượng muối khan sẽ thu được.
Vậy là bài học Ôn thi hóa lớp 9 học kì 1 đến đây đã kết thúc rồi. HOCMAI mong rằng với lượng kiến thức ở bài viết trên đây, các em học sinh đã nằm lòng những kiến thức ấy, chuẩn bị cho mình một tâm lý vững vàng trước khi bước vào phòng thi. Những kiến thức trên sẽ đi cùng các em tới hết Trung học Phổ thông, vậy nên HOCMAI mong muốn các em hiểu chúng thật sâu sắc, ghi nhớ chúng thật lâu dài. Các em cũng đừng quên truy cập hoctot.hocmai.vn để tìm thêm cho mình thật nhiều bài học bổ ích nữa nhé!
30 Đề thi học kì 1 môn Hóa học lớp 9 năm 2022 - 2023 Hay Chọn Lọc được đội ngũ giáo viên Vn
Doc biên soạn chi tiết chuẩn theo nội dung chương trình học, bộ đề thi học kì 1 hóa 9 được tổng hợp từ các để lẻ.
Hy vọng với 30 Đề thi học kì 1 môn Hóa học lớp 9 năm 2022 - 2023 Hay Chọn Lọc này còn giúp ích cho quý thầy cô trong quá trình ôn tập cũng như ra đề giữa kì 1 Hóa học 9.
A. Tài liệu ôn tập học kì 1 hóa 9
B. 30 đề thi học kì 1 hóa 9 năm 2022
Bản quyền thuộc về Vn
Doc nghiêm cấm mọi hành vi sao chép vì mục đích thương mại
C. Một số đề thi học kì 1 hóa 9 có đáp án
A. Đề kiểm tra học kì 1 hóa 9 - Đề 1
Biết: Ba = 137, Na = 23, K = 39, Fe = 56, C = 12, H =1, O= 16, S = 32, Cl =35,5, Mg =24, Al =27; Zn = 65, Cu = 64
Phần 1. Trắc nghiệm khách quan
Chọn đáp án đúng nhất trong các câu hỏi dưới đây
Câu 1. Dung dịch H2SO4 tác dụng với dãy chất là:
A. Fe, Ca
O, HCl, Ba
Cl2
B. Cu, Ba
O, Na
OH, Na2CO3
C. Mg, Cu
O, HCl, Na
Cl
D. Zn, Ba
O, Na
OH, Na2CO3
Câu 2. Phản ứng không tạo ra muối Fe(III):
A. Fe tác dụng với dd HCl
B. Fe2O3 tác dụng với dd HCl
C. Fe3O4 tác dụng với dd HCl
D. Fe(OH)3 tác dụng với dd H2SO4
Câu 3. Khí lưu huỳnh đioxit SO2 được tạo thành từ cặp chất là
A. K2SO4 và HCl.
B. K2SO4 và Na
Cl.
C. Na2SO4 và Cu
Cl2
D. Na2SO3 và H2SO4
Câu 4. Dung dịch của chất X có p
H >7 và khi tác dụng với dung dịch kali sunfat tạo ra chất không tan. Chất X là.
| A. Ba Cl2 | B. Na OH | C. Ba(OH)2 | D. H2SO4. |
Câu 5. Để loại bỏ khí CO2 có lẫn trong hỗn hợp (O2; CO2). Người ta cho hỗn hợp đi qua dung dịch chứa:
| A. HCl | B. Na2SO4 | C. Na Cl | D. Ca(OH)2. |
Câu 6. Có những chất khí sau: CO2; H2; O2; SO2; CO. Khi nào làm đục nước vôi trong.
| A. CO2 | B. CO2; CO; H2 | C. CO2; SO2 | D. CO2; CO; O2 |
Câu 7. Nhỏ vài giọt dung dịch Fe
Cl3 vào ống nghiệm đựng 1ml dung dịch Na
OH, thấy xuất hiện:
A. chất không tan màu nâu đỏ
B. chất không tan màu trắng
C. chất tan không màu
D. chất không tan màu xanh lơ
Câu 8. Cho dãy các kim loại sau : Fe, W, Hg, Cu kim loại trong dãy có nhiệt độ nóng chảy thấp nhất:
| A. W | B. Cu | C. Hg | D. Fe |
Phần 2. Tự luận (7 điểm)
Câu 1. Hoàn thành chuỗi phản ứng hóa học sau:
Al → Al2O3 → Na
Al
O2 → Al(OH)3 → Al2(SO4)3 → Al
Cl3 → Al(NO3)3
Câu 2. Nêu hiện tượng và viết phương trình hóa học xảy ra trong các thí nghiệm sau:
a) Nhúng đinh sắt đã cạo sạch gỉ vào dung dịch Cu
SO4
b) Sục khí CO2 vào nước vôi trong
Câu 3. Có 4 lọ mất nhãn chứa 4 dung dịch HCl, Na2SO4, Na
Cl, Ba(OH)2. Chỉ dùng quỳ tím và chính các chất này để xác định các dung dịch trên.
Câu 4. Cho 7,5 gam hỗn hợp X gồm Al, Mg tác dụng với dung dịch HCl 14,6% (vừa đủ) thu được 7,84 lít khí (đktc) và dung dịch Y.
a) Viết phương trình hóa học xảy ra.
b) Tính thành phần % khối lượng của mỗi kim loại có trong hỗn hợp X.
............................Hết............................
Đáp án đề thi học kì 1 hóa 9 năm học 2022 Đề 1
Phần 1. Trắc nghiệm
| 1 D | 2 A | 3 D | 4 C |
| 5 D | 6 C | 7 A | 8 C |
Phần 2. Tự luận
Câu 1.
1) 4Al + 3O2 → 2Al2O3
2) Al2O3 + 2Na
OH → 2Na
Al
O2 + H2O
3) Na
Al
O2 + 2H2O → Na
OH + Al(OH)3
4) 2Al(OH)3 + 3Zn
SO4 → Al2(SO4)3 + 3Zn(OH)2
5) Al2(SO4)3 + 3Ba
Cl2 → 2Al
Cl3 + 3Ba
SO4
6) Al
Cl3 + 3Ag
NO3 → Al(NO3)3 + 3Ag
Cl
Câu 2.
a) Nhúng đinh sắt đã cạo sạch gỉ vào dung dịch Cu
SO4
Hiện tượng: đinh sắt tan dần, màu xanh của dung dịch đồng sunfat nhạt dần. Sau 1 thời gian lấy đinh sắt ra thì thấy 1 lớp kim loại màu đỏ gạch bám ngoài (đó chính là đồng).
Fe + Cu
SO4 → Fe
SO4 + Cu
b) Sục khí CO2 vào nước vôi trong
Hiện tượng: Khi sục khí CO2 vào nước vôi trong Ca(OH)2 xuất hiện kết tủa trắng Ca
CO3
CO2 + Ca(OH)2 → Ca
CO3 + H2O
c) Cho từ từ dung dịch Ba
Cl2 vào ống nghiệm chứa dung dịch H2SO4
Hiện tượng: Khi cho từ từ dung dịch dung dịch Ba
Cl2 vào ống nghiệm chứa dung dịch H2SO4 sau phản ứng xuất hiện kết tủa trắng
Ba
Cl2 + H2SO4 → Ba
SO4 + 2HCl
Câu 3. Có 4 lọ mất nhãn chứa 4 dung dịch HCl, Na2SO4, Na
Cl, Ba(OH)2. Chỉ dùng quỳ tím và chính các chất này để xác định các dung dịch trên.
Trích mẫu thuốc thử và đánh số thứ tự
| HCl | Na2SO4 | Na Cl | Ba(OH)2 | |
| Quỳ tím | Quỳ chuyển sang màu đỏ | Quỳ không chuyển màu | Quỳ không chuyển màu | Quỳ chuyển sang màu xanh |
| Na2SO4 | Không phản ứng | - | - | Kết tủa trắng |
| Na Cl | Không phản ứng | - | - | Không phản ứng |
Dấu (-) đã nhận biết được
Phương trình phản ứng xảy ra:
Na2SO4 + Ba(OH)2 → Ba
SO4 + 2Na
OH
Câu 4.
a) Phương trình hóa học:
2Al + 6HCl → 2Al
Cl3 + 3H2 (1)
Mg + 2HCl → Mg
Cl2 + H2 (2)
b) n
H2 = 0,35 mol
Gọi x, y lần lượt là số mol của Al, Mg
Theo đề bài ta có:
27x + 24y = 7,5 (3)
Dựa vào phương trình (1), (2) ta có: 3/2x + y = 0,35 (4)
Giải hệ phương trình ta được: x = 0,1; y = 0,2
m
Al = 27.0,1 = 2,7 gam => %m
Al = (2,7/7,5).100 = 36%
%m
Mg = 100% - 36% = 64 %
............................
B. Đề kiểm tra học kì 1 hóa 9 - Đề 2
Biết: Ba = 137, Na = 23, K = 39, Fe = 56, C = 12, H =1, O= 16, S = 32, Cl =35,5, Mg =24, Al =27; Zn = 65, Cu = 64
Phần 1. Trắc nghiệm khách quan
Chọn đáp án đúng nhất trong các câu hỏi dưới đây
Câu 1. Dãy nào dưới đây gồm các dung dịch muối tác dụng được với kim loại Mg?
A. Zn
Cl2, Fe(NO3)2 và Cu
SO4
B. Ca
Cl2, Na
Cl và Cu(NO3)2
C. Ca
Cl2, Na
NO3 và Fe
Cl3
D. Ca(NO3)2, Fe
Cl2 và Cu
SO4
Câu 2. Để phân biệt được các dung dịch HCl, H2SO4 và Ba(OH)2 chỉ cần dùng kim loại nào sau đây?
| A. K | B. Na | C. Ba | D. Cu |
Câu 3. Dãy nào dưới đây được sắp xếp theo thứ tự giảm dần mức độ hoạt động hóa học
A. K, Ag, Fe, Zn
B. Ag, Fe, K, Zn
C. K, Zn, Fe, Ag
D. Ag, Fe, Zn, K
Câu 4. Nhỏ từ từ dung dịch axit clohiđric vào cốc đựng một mẩu đá vôi cho đến dư axit. Hiện tượng nào sau đây xảy ra?
A. Sủi bọt khí, đá vôi không tan
B. Đá vôi tan dần, không sủi bọt khí.
C. Không sủi bọt khí, đá vôi không tan
D. Sủi bọt khí, đá vôi tan dần.
Câu 5. Cặp chất nào dưới đây không thể tồn tại trong cùng một dung dịch.
A. Na
NO3 và HCl
B. Na
NO3 và Ba
Cl2
C. K2SO4 và Ba
Cl2
D. Ba
CO3 và Na
Cl
Câu 6. Để phân biệt 3 kim loại Fe, Mg và Al cần dùng
A. Dung dịch HCl và dung dịch Na
OH
B. H2O và dung dịch HCl
C. Dung dịch Na
OH và H2O
D. Dung dịch Cu
Cl2 và H2O
Câu 7. Muối nào dưới đây không bị nhiệt phân hủy
| A. KMn O4 | B. KCl O3 | C. KNO3 | D. KCl |
Câu 8. Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong bình khí clo dư
(2) Cho Fe vào dung dịch HNO3 đặc, nguội
(3) Cho Fe vào dung dịch HCl loãng, dư
(4) Cho Fe vào dung dịch HCl loãng, dư
(5) Cho Fe vào dung dịch H2SO4 đặc, nóng
Số thí nghiệm tạo ra muối Fe(II) là:
| A. 3 | B. 4 | C. 2 | D. 1 |
Phần 2. Tự luận
Câu 1. (2 điểm) Hoàn thành sơ đồ phản ứng hóa học sau:
S → SO2 → SO3 → H2SO4 → SO2 → H2SO3 → Na2SO3 → SO2
Câu 2. (2 điểm) Có 3 lọ mất nhãn chứa 3 dung dịch HCl, H2SO4, Ba
Cl2. Chỉ dùng quỳ tím và chính các chất này để xác định các dung dịch trên.
Câu 3. (3 điểm) Cho 2,56 gam Cu vào cốc đựng 40 ml dung dịch Ag
NO3 1 M. Sau phản khi phản ứng xảy ra hoàn toàn thu được dung dịch X và m gam chất rắn Y.
a) Xác định các chất trong dung dịch X và chất rắn Y.
b) Tính nồng độ mol chất tan trong X và giá trị của m. Giả sử thể tích dung dịch thay đổi không đáng kể.
............................Hết............................
Đáp án đề thi học kì 1 hóa 9 năm học 2022 Đề 2
Phần 1. Trắc nghiệm
| 1 A | 2 C | 3 D | 4 D |
| 5 C | 6 A | 7 D | 8 C |
Phần 2. Tự luận
Câu 1
(1) S + O2

(2) SO2 + O2

(3) SO3 + H2O → H2SO4
(4) H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O
(5) SO2 + H2O→ H2SO3
(6) H2SO3 + 2Na
OH → Na2SO3 + 2H2O
(7) H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O
Câu 2. Trích mẫu thử và đánh số thứ tự.
Bước 1: Nhúng quỳ tím vào 3 dung dịch trên.
Dung dịch không làm đổi màu quỳ là Ba
Cl2
Dùng dịch làm quỳ chuyển sang đỏ là: HCl, H2SO4
Bước 2: Nhỏ dung dịch Ba
Cl2 vừa nhận biết được ở trên vào 2 dung dịch axit
Dung dịch không xảy ra phản ứng là HCl
Dung dịch phản ứng tạo kết tủa trắng là H2SO4 loãng
Ba
Cl2 +H2SO4 → Ba
SO4 ↓+ 2HCl
Câu 3.
n
Cu = 0,04 mol
n
Ag
NO3 = 0,04 mol
a) Phương trình hóa học:
Cu + 2Ag
NO3 → Cu(NO3)2 + 2Ag
0,02 ← 0,04 → 0,02 → 0,04
Sau phản ứng, Cu dư, Ag
NO3 phản ứng hết
Vậy dung dich X: 0,02 mol Cu(NO3)2
Chất rắn Y: 0,04 mol Ag và 0,02 mol Cu dư
b) Nồng độ mol Cu(NO3)2

Khối lượng rắn Y
m = m
Ag + m
Cu(dư) = 0,04.108 + 0,02.64 = 5,6 gam
C. Đề kiểm tra học kì 1 hóa 9 - Đề 3
Chọn đáp án đúng nhất trong các câu hỏi dưới đây
Biết: Ba = 137, Na = 23, K = 39, Fe = 56, C = 12, H =1, O= 16, S = 32, Cl =35,5, Mg =24, Al =27; Zn = 65, Cu = 64
Câu 1. Chất phản ứng được với dung dịch acid Clohiđric sinh ra chất khí nhẹ hơn không khí, cháy trong không khí với nhọn lửa màu xanh nhạt:
| A. Ba CO3 | B. Ag | C.Fe Cl3 | D. Zn |
Câu 2. Các khí ẩm được làm khô bằng Ca
O là:
| A. H2; O2; N2. | B. H2; CO2; N2. |
| C. H2; O2; SO2. | D. CO2; SO2; HCl. |
Câu 3. Dãy nào sau đây gồm các chất tác dụng được với dung dịch Ca(OH)2
A. CO2, Na
HCO3, Na2CO3
B. CO, Na2CO3, Na
Cl
C. CO2, Na
Cl, Na
HCO3
D. CO, CO2, Na2CO3
Câu 4. Trong các loại phân bón sau, loại phân bón nào có lượng đạm cao nhất?
| A. NH4NO3 | B. NH4Cl | C. (NH4)2SO4 | D. (NH2)2CO |
Câu 5. Chất tác dụng với axit sunfuric loãng tạo thành muối và nước:
| A. Cu | B. Cu O | C. Cu SO4 | D. CO2 |
Câu 6. Muối nào sau đây không bị nhiệt phân hủy
| A. Ca CO3 | B. Na2CO3 | C. KNO3 | D. KCl O3 |
Câu 7. Dung dịch Fe(NO3)3 có lẫn tạp chất Ag
NO3. Dùng kim loại nào sau đây để làm sạch dung dịch Fe(NO3)3
| A. Ag | B. Fe | C. Cu | D. Zn |
Câu 8. Để trung hòa 11,2 gam KOH 20%, thì cần lấy bao nhiêu gam dung dịch axit H2SO4 35%
| A. 9gam | B. 4,6gam | C. 5,6gam | D. 1,7gam |
Câu 9. Dung dịch H2SO4 có thể tác dụng được
A. CO2, Mg, KOH.
B. Mg, Na2O, Fe(OH)3
C. SO2, Na2SO4, Cu(OH)2
D. Zn, HCl, Cu
O.
Câu 10. Hòa tan 2,4 gam oxit của kim loại hoá trị II vào 21,9 gam dung dịch HCl 10% thì vừa đủ. Oxit đó là:
| A. Cu O | B. Ca O | C. Mg O | D. Fe O |
Câu 11. Dung dịch của chất X có p
H >7 và khi tác dụng với dung dịch kali sunfat tạo ra chất không tan. Chất X là.
| A. Ba Cl2 | B. Na OH | C. Ba(OH)2 | D. H2SO4 |
Câu 12. Có hai lọ đựng dung dịch bazơ Na
OH và Ca(OH)2. Chất dùng để phân biệt hai chất trên:
| A. Na2CO3 | B. Na Cl | C. Mg O | D. HCl |
Câu 13. Những cặp chất cũng tồn tại trong một dung dịch.
A. KCl và Na
NO3.
B. KOH và HCl
C. Na3PO4 và Ca
Cl2
D. HBr và Ag
NO3.
Câu 14. Nhỏ vài giọt dung dịch Fe
Cl3 vào ống nghiệm đựng 1ml dung dịch Na
OH, thấy xuất hiện:
A .chất tan không màu
B. chất không tan màu trắng
C. chất không tan màu nâu đỏ
D. chất không tan màu xanh lơ
Câu 15. Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch H2SO4 loãng dư, thu được 2,24 lít khí(đktc). Phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
A. 61,9% và 38,1%
B. 50% và 50%
C. 40% và 60%
D. 30% và 70%
Câu 16. Dãy nào dưới đây được sắp xếp theo thứ tự tăng dần mức độ hoạt động hóa học
A. Na, Al, Cu, Zn
B. Cu, Al, Zn, Na
C. Na, Al, Zn, Cu
D. Cu, Zn, Al, Na
Câu 17. Để nhận ra sự có mặt của các chất khí CO, CO2, trong hôn hợp khí gồm CO, CO2, O2, N2, có thể dẫn hỗn hợp khí qua.
A. bình đựng nước vôi trong dư, sau đó qua ống sứ đựng bột Cu
O nung nóng
B. ống sứ đựng bột Cu
O nung nóng, sau đó dẫn qua bình đựng nước vôi trong
C. bình (1) đựng nước và bình (2) đựng nước vôi trong
D. ống đựng bột Cu
O nung nóng, sau đó qua bình đựng nước
Câu 18. Hấp thụ hoàn toàn 11,2 lít khí CO2 (đktc) bằng một dung dịch chứa 20 g Na
OH. Muối được tạo thành là:
A. Na2CO3.
B. Na
HCO3
C. Hỗn hợp Na2CO3 và Na
HCO3.
D. Na(HCO3)2
Câu 20. Một phần lớn vôi sống được dùng trong công nghiệp luyện kim và làm nguyên liệu cho công nghiệp hóa học. Công thức hóa học của vôi sống là:
A. Na2O
B. Ca(OH)2
C. Ca
O
D. Ca
CO3
Câu 21. Cặp chất nào sau đây khi phản ứng không sinh khs CO2?
A. Ca
CO3 và HCl
B. K2CO3 và Ba(OH)2
C. CO và O2
D. KHCO3 và HCl
Câu 22. Sắt (III) oxit (Fe2O3) tác dụng được với:
A. Nước, sản phẩm là axit.
B. Axit, sản phẩm là muối và nước.
C. Nước, sản phẩm là bazơ.
D. Bazơ, sản phẩm là muối và nước.
Câu 23. Trong thành phần nước Gia-ven có
A. Na
Cl và HCl
B. Na
Cl và Na
Cl
O
C. Na
Cl
O và HCl
D. Na
Cl, Na
Cl
O3
Câu 24. Cho Clo tác dụng vừa đủ nhôm tạo ra 26,7 gam Al
Cl3: Số gam Cl2 cần dùng là:
| A. 21,3 gam | B. 12,3 gam | C. 13,2 gam | D. 23,1 gam |
Câu 25. Cho khí CO dư đi qua hỗn hợp gồm Cu
O, Al2O3, Mg
O (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm:
A. Cu, Al, Mg
B. Cu, Al, Mg
O
C. Cu, Al2O3, Mg
D. Cu, Al2O3, Mg
O
Câu 26. Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào vỏ tàu (phần ngập dưới nước) những tấm kim loại:
| A . Zn | B. Cu | C. Sn | D. Pb |
Câu 27. Cho dãy các kim loại sau: Fe, W, Hg, Cu kim loại trong dãy có nhiệt độ nóng chảy thấp nhất:
| A . W | B. Cu | C. Hg | D. Fe |
Câu 28. Dẫn 4,48 lít khí CO (đktc) đi vào ống đựng Fe2O3 nung nóng, sau một thời gian thấy khối lượng chất rắn trong ống giảm 2,4 gam. Khí đi ra khỏi ống có phần trăm thể tích CO2 bằng
| A. 25% | B. 75% | C. 50% | C. 40% |
Câu 29. Phát biểu nào sau đây không đúng?
A. Khi cho sắt tác dụng với dung dịch HCl tạo thành muối và Fe
Cl2
B. Khi cho clo tác dụng với sắt tạo thành muối Fe
Cl3
C. Khi cho clo tác dụng với sắt tạo thành muối Fe
Cl2
D. Khi cho clo tác dụng với Fe
Cl2 tạo thành muối Fe
Cl3
Câu 30. Cho sơ đồ chuyển hóa sau:
Cacbon → X → Y → Z →Y
Các chất X, Y, Z có thể là
A. CO2, Ca
CO3, Ca(OH)2
B. CO, CO2, Ca
CO3
C. CO, Ca
CO3, Ca(HCO3)2
D. CO, Ca(HCO3)2, Ca
CO3
...........................HẾT........................
Đáp án đề thi học kì 1 hóa 9 năm học 2022 Đề 3
| 1 D | 2 A | 3 A | 4 D | 5 B | 6 B | 7 B | 8 C | 9 B | 10 A |
| 11 C | 12 A | 13 A | 14 C | 15 A | 16 C | 17A | 18 B | 19 D | 20 C |
| 21 B | 22 B | 23 C | 24 A | 25 D | 26 A | 27C | 28 B | 29 C | 30 B |
Hướng dẫn giải chi tiế 1 số câu hỏi khó
Câu 10.
Gọi kim loại hóa trị II là R => công thức oxit là RO
m
HCl = 21,9.10%100%=2,19(gam) ⇒ n
HCl = 0,06 mol
Phương trình hóa học
RO + 2HCl → RCl2 + H2O
0,03mol ← 0,06mol
⇒MRO=2,4/0,03 = 80 => MR + 10 = 80 => MR = 64
=> R là Cu
=> Công thức oxit cần tìm là Cu
O
Câu 15.
Chỉ có Zn phản ứng với H2SO4, Cu không phản ứng.
n
H2 = 0,1 mol
Zn + H2SO4 → Zn
SO4 + H2
0,1 ← 0,1 mol
=> m
Cu = 10,5 – mZn = 10,5 – 0,1.65 = 4 gam
%m
Zn= 6,5/10,5.100% = 61,9%;
%m
Cu = 38,1%
Câu 18.
Phương trình hóa học:
CO2 + 2Na
OH → Na2CO3 + H2O
CO2 + Na
OH → Na
HCO3
Xét tỉ lệ: n
Na
OH/n
CO2 = a
+ Gía trị a = 1 ⇒ Sản phẩm tạo muối Na
HCO3
+ Gía trị a = 2 ⇒ Sản phẩm tạo muối Na2CO3
+1 2CO3 và muối Na
HCO3
Cụ thể ở bài này:
Số mol CO2 = 11,2 /22,4 = 0,5 (mol)
Số mol Na
OH = 20/40 = 0,5 (mol)
Gía trị a = 1 ⇒ Sản phẩm tạo muối Na
HCO3
Câu 28.
CO + Ooxit → CO2
Ta có: m
O = mgiảm = 2,4 (gam)
Có : n
CO pư = n
CO2= n
O= 2,4/16 = 0,15 (mol)
Sau phản ứng, khí gồm :
CO2 : 0,15 (mol)
CO : 0,2 - 0,15 = 0,05(mol)
Vậy :
%VCO2 = 0,15/(0,15 + 0,05).100%=75%
D. Đề kiểm tra học kì 1 hóa 9 - Đề 4
Câu 1. Dung dịch H2SO4 tác dụng với dãy chất là:
A. Fe, Ca
O, HCl.
B. Cu, Ba
O, Na
OH.
C. Mg, Cu
O, HCl.
D. Zn, Ba
O, Na
OH.
Câu 2. Để phân biệt 2 dung dịch HCl và H2SO4. Người ta dùng thuốc thử là:
A. Quỳ tím.
B. Zn.
C. dung dịch Na
OH.
D. dung dịch Ba
Cl2.
Câu 3. Chất gây ô nhiễm và mưa axit là
A. Khí O2.
B. Khí SO2.
C. Khí N2.
D. Khí H2.
Câu 4. Chất tác dụng được với HCl và CO2:
A. Sắt
B. Nhôm
C. Kẽm
D. Dung dịch Na
OH.
Câu 5. Phương pháp được dùng để sản xuất khí sunfurơ trong công nghiệp.
A. Phân hủy canxi sunfat ở nhiệt độ cao.
B. Đốt cháy lưu huỳnh trong oxi.
C. Cho đồng tác dụng với axit sunfuric đặc, nóng.
D. Cho muối natrisunfit tác dụng với axit clohiđric.
Câu 6. Dùng Canxi oxit để làm khô khí:
A. Khí CO2
B. Khí SO2
C. Khí HCl
D. CO
Câu 7. Dung dịch axit mạnh không có tính chất là:.
A. Tác dụng với oxit axit tạo thành muối và nước.
B. Tác dụng với bazơ tạo thành muối và nước.
C. Tác dụng với nhiều kim loại giải phóng khí hiđrô.
D. Làm đổi màu quỳ tím thành đỏ.
Câu 8. Hòa tan 23,5 gam K2O vào nước. Sau đó dùng 250ml dung dịch HCl để trung hòa dung dịch trên. Tính nồng độ mol HCl cần dùng.
| A. 1,5M | B. 2,0M | C. 2,5 M | D. 3,0 M |
Câu 9. Khí lưu huỳnh đioxit SO2 được tạo thành từ cặp chất là
A. K2SO4 và HCl.
B. K2SO4 và Na
Cl.
C. Na2SO4 và Cu
Cl2
D. Na2SO3 và H2SO4
Câu 10. Dung dịch của chất X có p
H >7 và khi tác dụng với dung dịch kali sunfat tạo ra chất không tan. Chất X là.
A. Ba
Cl2
B. Na
OH
C. Ba(OH)2
D. H2SO4.
Câu 11. Nhỏ một giọt quỳ tím vào dung dịch KOH, dung dịch có màu xanh; nhỏ từ từ dung dịch H2SO4 cho tới dư, vào dung dịch có màu xanh trên thì.
A. Màu xanh vẫn không thay đổi.
B. Màu xanh nhạt dần rồi mất hẳn.
C. Màu xanh nhạt dần rồi mất hẳn, rồi chuyển sanh màu đỏ
D. Màu xanh đậm thêm dần.
Câu 12. Để phân biệt 3 gói bột: Fe, Cu và Al có thể dùng các dung dịch
A. Na
OH và Fe
Cl2
B. HCl và Cu
Cl2
C. Ca(OH)2 và Na
Cl
D. HCl và Na
OH
Câu 13. Có những chất khí sau: CO2; H2; O2; SO2; CO. Khi nào làm đục nước vôi trong .
A. CO2
B. CO2; CO; H2
C. CO2 ; SO2
D. CO2; CO; O2
Câu 14. Ca
O phản ứng được với tất cả các chất trong dãy
A. Na
OH; Ca
O; H2O
B. Ca
O; K2SO4; Ca(OH)2
C. H2O; Na2O; Ba
Cl2
D.CO2; H2O; HCl
Câu 15. Khí CO tác dụng được với tất cả các chất trong dãy nào sau đây?
A. Fe2O3, Cu
O, O2, Pb
O
B. Cu
O, Ca
O, C, O2
C. Al2O3, C, O2, Pb
O
D. Fe2O3, Al2O3, Ca
O, O2
Câu 16. Đốt cháy 48 gam Lưu huỳnh với khí oxi, sau phản ứng thu được 96 gam khí Sunfuro. Khối lượng của oxi tác dụng là:
A. 40g
B. 44g
C. 48g
D. 52g
Câu 17. Để hòa tan hoàn toàn 1,3 g kẽm thì cần 14,7g dung dịch H2SO4 20%. Khi phản ứng kết thúc khối lượng hiđro thu được là:
A. 0,03g
B. 0,04g
C. 0,05g
D. 0,06g
Câu 18. Hòa tan hoàn toàn 14,40 gam kim loại M (hóa trị II) trong dung dịch H2SO4 loãng, dư thu được 13,44 lít khí H2 (đktc). Kim loại M là :
A . Mg
B. Ca
C. Be
D. Ba
Câu 19. Phản ứng giữa các chất nào sau đây không tạo ra muối sắt (II)?
A. Fe với dung dịch HCl
B. Fe với dung dịch Hg
Cl2
C. Fe
O với dung dịch H2SO4 loãng
D. Fe với Cl2
Câu 20. Khối lượng Fe có thể điều chế được 200 tấn quặng hematit chứa 60% Fe2O3 là
A. 42 tấn
B. 64 tấn
C. 80 tấn
D. 78,13 tấn
Câu 21. Đinh sắt không bị ăn mòn trong trường hợp nào sau đây?
A. Để đinh sắt trong không khí khô.
B. Ngâm đinh sắt trong ống nghiệm đựng nước có hòa tan khí oxi.
C. Ngâm đinh sắt trong ống nghiệm đựng nước muối
D. Ngâm đinh sắt trong ống nghiệm đựng nước có nhỏ vài giọt axit HCl
Câu 22. Để sản xuất gang trong công nghiệp, cần có các nguyên liệu:
A. Quặng pirit sắt (Fe
S2), than cốc, không khí và chất phụ gia
B. Sắt phế thải, than cốc, không khí và chất phụ gia.
C. Sắt phế thải, không khí và chất phụ gia
D. Quặng sắt hemantit (Fe2O3) hoặc manhetit (Fe3O4), tha cốc, không khí và chất phụ gia
Câu 23. Muối Fe(NO3)2 có lẫn ít muối Ag
NO3. Có thể dùng kim loại nào sau đây để làm sạch dung dịch Fe(NO3)2?
A. Zn
B. Fe
C. Cu
D. Ag
Câu 24. Cho 5,4 gam hỗn hợp 2 kim loại Fe và Zn tác dụng hoàn toàn với 90 ml dung dịch HCl 2M. Khối lượng muối thu được là
A. 11,79 gam
B. 11,5 gam
C. 15,71 gam
D. 17,19 gam
Câu 25. Cho 5,4 gam Al vào dung dịch Na
OH loãng, dư, sau phản ứng thu được V lít khí H2 (ở đktc)
A. 4,48 lít
B. 6,72 lít
C. 8,96 lít
D. 5,04 lít
Câu 26. Các đồ vật bằng nhôm bền trong không khí và nước là do:
A. Có một lớp Al(OH)3 bên ngoài bảo vệ
B. Có một lớp Al2O3 bên ngoài bảo vệ
C. Nhôm không tan trong nước
D. Nhôm bền, không bị oxi hóa
Câu 27. Kim loại X có nhiệt độ nóng chảy cao nhất, được sử dụng làm dây tóc bóng đèn. Kim loại X là:
A. Vonfram
B. Sắt
C. Thủy ngân
D. Vàng
Câu 28. Dãy nào dưới đây được sắp xếp theo thứ tự giảm dần mức độ hoạt động hóa học
A. K, Ag, Fe, Zn
B. Ag, Fe, K, Zn
C. K, Zn, Fe, Ag
D. Ag, Fe, Zn, K
Câu 29. Trong số các kim loại X, Y, Z, T thì chỉ có:
X và Y đứng trước H trong dãy hoạt động hóa học kim loại
X và T đẩy được Z ra khỏi dung dịch muối tương ứng.
Dãy sắp xếp các kim loại theo chiều giảm dần mức độ hoạt động hóa học là
A. X, Y, Z, T
B. X, Y, T, Z
C. Z, T, X, Y
D. Y, X, T, Z
Câu 30. Khi cho kim loại Mg (dư) vào dung dịch gồm 2 muối Cu(NO3)2 và Ag
NO3, sản phẩm thu được gồm
A. hai kim loại và một muối
B. ba kim loại và một muối
C. ba kim loại và hai muối
D. hai kim loại và 2 muối
...........................HẾT........................
Đáp án đề thi học kì 1 hóa 9 năm học 2022 Đề 4
| 1 D | 2 D | 3 B | 4 D | 5 C | 6 D | 7 A | 8 B | 9 D | 10 C |
| 11 C | 12 A | 13 C | 14 D | 15 A | 16 C | 17 B | 18 A | 19 D | 20 B |
| 21 A | 22 D | 23 B | 24 A | 25 B | 26 B | 27 A | 28 D | 29 D | 30 C |
E. Đề kiểm tra học kì 1 hóa 9 - Đề 5
Câu 1. Oxit axit nào sau đây được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm?
| A. SO2 | B. SO3 | C. N2O5 | D. P2O5 |
Câu 2. Kim loại nào sau đây là kim loại dẻo nhất trong số các kim loại?
| A. Ag (bạc) | B. Au (vàng) | C. Al (nhôm) | D. Cu (đồng) |
Câu 3. Khí O2 bị lẫn tạp chất là các khí CO2, SO2, H2S. Có thể dùng chất nào sau đẩy để loại bỏ tạp chất?
A. Nước
B. Dung dịch H2SO4 loãng
C. Dung dịch Cu
SO4
D. Dung dịch Ca(OH)2
Câu 4. Sản phẩm của phản ứng phân hủy Cu(OH)2 bởi nhiệt là:
A. Cu
O và H2
B. Cu, H2O và O2
C. Cu, O2 và H2
D. Cu
O và H2O
Câu 24. Cho a g Cu
O tác dụng với dung dịch H2SO4 thu được 200g dung dịch Cu
SO4 nồng độ 16%. Giá trị của a là:
| A. 12g | B. 14g | C. 15g | D. 16g |
Câu 5. Dùng thuốc thử nào sau đây có thể dùng để phân biệt dung dịch Na2SO4 và dung dịch Na2CO3?
A. dung dịch Ba
Cl2
B. dung dịch axit HCl
C. dung dịch Pb(NO3)2
D. dung dịch Ag
NO3
Câu 6. Cặp chất nào trong số các cặp chất cho dưới đây có thể cùng tồn tại trong một dung dịch?
A. Na
OH và HBr
B. H2SO4 và Ba
Cl2
C. KCl và Na
NO3
D. Na
Cl và Ag
NO3
Câu 7. Cho các chất: Ca, Ca(OH)2, Ca
CO3, Ca
O. Dãy biến đổi nào sau đây có thể thực hiện được?
A. Ca → Ca
CO3 → Ca(OH)2 → Ca
O
B. Ca → Ca
O → Ca(OH)2 → Ca
CO3
C. Ca
CO3 → Ca → Ca
O → Ca(OH)2
D. Ca
CO3 → Ca(OH)2 → Ca → Ca
O
Câu 8. Dãy kim loại nào sau đây được sắp theo thứ tự hoạt động hóa học tăng dần?
A. Na, Al, Zn, Fe, Cu, Ag
B. Al, Na, Zn, Fe, Ag, Cu
C. Ag, Cu, Fe, Zn, Al, Na
D. Ag, Cu, Fe, Zn, Al, Na
Câu 9. Có dung dịch Al
Cl3 lẫn tạp chất là Cu
Cl2. Có thể dùng chất nào sau đây để làm sạch muối nhôm?
| A. Ag NO3 | B. HCl | C. Mg | D. A |
Câu 10. Dung dịch Ba(OH)2 có phản ứng với tất cả các chất nào sau đây:
A. Fe
Cl3, Mg
Cl2, Cu
O, HNO3
B. H2SO4, SO2, CO2, Fe
Cl2
C. Na
OH, HCl, Cu
SO4, KNO3
D. Fe2O3, Al, H3PO4 , Ba
Cl2
Câu 11. Cho 5,6g bột sắt vào bình khí clo có dư. Sau đó thu được 16,25g muối sắt. Tính khối lượng khí clo đã tham gia phản ứng?
| A. 11,5g | B. 10,65g | C. 13,17g | D. 11,82g |
Câu 12. Chất nào sau đây không phản ứng với Cl2?
| A. Na Cl | B. Na OH | C. Fe | D. Ca(OH)2 |
Câu 13. Trung hòa 200 ml dung dịch H2SO4 1M bằng dung dịch Na
OH 20%. Khối lượng dung dịch Na
OH cần dùng là:
| A. 100 gam | B. 80 gam | C. 90 gam | D. 150 gam |
Câu 14. Hấp thụ hoàn toàn 11,2 lít khí CO2 (đktc) bằng một dung dịch chứa 20 g Na
OH. Muối được tạo thành là:
| A. Na2CO3. | B. Na HCO3 |
| C. Hỗn hợp Na2CO3 và Na HCO3. | D. Na(HCO3)2 |
Câu 15. Để phân biệt 3 kim loại Fe, Mg và Al cần dùng
A. Dung dịch HCl và dung dịch Na
OH
B. H2O và dung dịch HCl
C. Dung dịch Na
OH và H2O
D. Dung dịch Cu
Cl2 và H2O
Câu 16. Kim loại có hóa trị II. Cho 8,4 gam kim loại này tác dụng hết với dung dịch HCl sinh ra 7,84 lít khí hidro (đktc). Kim loại M là:
| A. Cu | B. Zn | C. Mg | D. Fe |
Câu 17. Trong trường hợp nào sau đây thanh nhôm bị ăn mòn nhanh nhất?
A. Ngâm trong lọ đựng nước cất
B. Ngâm trong lo đựng dung dịch Cu
Cl2
C. Ngâm trong lọ đựng dung dịch HCl loãng.
D. Ngâm trong lọ đựng dung dịch HCl đặc nóng.
Câu 18. Chọn phản ứng thích hợp để phân biệt 3 khí: CO, Cl2 và CO2
A. Dùng giấy quỳ tím ướt
B. Dùng phenolphtalein
C. Dùng dung dịch Ca(OH)2
D. Dùng dung dịch KCl
Câu 19. Thực hiện các thí nghiệm sau
1) Đốt dây sắt trong bình đựng khí oxi
2) Cho miếng kẽm tác dụng với HCl
3) Cho Sắt tác dụng với dung dịch H2SO4 đặc nóng
4) Cho nhôm tác dụng với dung dịch kiềm Na
OH
Số thí nghiệm phản ứng sinh ra khí hidro là:
| A. 1 | B. 2 | C. 3 | D. 4 |
Câu 20. Khi cho kim loại Mg (dư) vào dung dịch gồm 2 muối Cu(NO3)2 và Ag
NO3, sản phẩm thu được gồm
A. hai kim loại và một muối
B. ba kim loại và một muối
C. ba kim loại và hai muối
D. hai kim loại và 2 muối
Câu 21. Trong phòng thí nghiệm, khí CO2 thường được điều chế bằng cách nào.
A. cho dung dịch HCl tác dụng với đá vôi
B. nhiệt phân canxi cacbonat
C. đốt cacbon trong bình khí oxi
D. nhiệt phân Na
HCO3 trong dung dịch
Câu 22. Dung dịch axit clohiđric tác dụng với đồng (II) hiđrôxit tạo thành dung dịch màu:
| A. Vàng đậm | B. Đỏ | C. Xanh lam | D. Da cam |
Câu 23. Để trung hòa tan dung dịch chứa 16 gam Na
OH cần 100 gam dung dịch H2SO4. Nồng độ phần trăm của dung dịch axit đã dùng là:
| A. 19,6% | B. 16,9% | C. 32,9% | D. 39,2% |
Câ 24. Một hợp chất có chứa 27,59% oxi về khối lượng, còn lại là Fe. Công thức của oxit sắt đó là:
A. Fe
O
B. Fe2O3
C. Fe3O4
D. Fe(OH)2
Câu 25. Phát biểu nào sau đây đúng?
A. Gang là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm từ 2 - 5%.
B. Gang là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon lớn hơn 5%.
C. Gang là hợp kim của nhôm với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm từ 2 - 5%.
D. Gang là hợp kim của nhôm với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm lớn hơn 5%.
Câu 26. Cặp chất nào dưới đây không xảy ra phản ứng
A. Fe và Cu
Cl2
B. Fe và Fe2(SO4)3
C. Fe và H2SO4 đặc nguội
D. Fe và HCl
Câu 27. Chất tác dụng với dung dịch HCl tạo thành chất khí nhẹ hơn không khí là:
A. Mg
B. Ca
CO3
C. Mg
CO3
D. Na2SO3
Câu 28. Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may đánh vỡ nhiệt kế thủy ngân thì có thể dùng chất nào cho dưới đây để khử độc?
A. Bột sắt
B. Bột lưu huỳnh
C. Nước
D. Nước vôi
Câu 29. Trộn bột C vừa đủ với hỗn hợp bột gồm Al2O3, Cu
O và Fe
O, sau đó cho hỗn hợp vào ống sứ nung nóng đến khi phản ứng hoàn toàn. Chất rắn thu được trong ống sứ là
A. Al, Fe, Cu
B. Al, Fe
O, Cu
C. Al2O3, Fe
O, Cu
D. Al2O3, Fe, Cu
Câu 30. Khử 4,64g hỗn hợp A gồm Fe
O, Fe3O4, Fe2O3 có số mol bằng nhau bằng CO thu được chất rắn B. Khí thoát ra sau phản ứng được dẫn vào dung dịch Ba(OH)2 dư thu được 1,97g kết tủa. Khối lượng của chất rắn B là:
| A. 4,4g | B. 4,84g | C. 4,48g | D. 4,45g |
............................Hết............................
Đáp án đề thi học kì 1 hóa 9 năm học 2022 Đề 5
| 1D | 2B | 3D | 4D | 5B | 6C | 7B | 8A | 9D | 10B |
| 11B | 12A | 13B | 14B | 15A | 16C | 17D | 18A | 19B | 20C |
| 21A | 22C | 23 | 24B | 25A | 26C | 27A | 28A | 29D | 30C |
F. Đề kiểm tra học kì 1 hóa 9 - Đề 6
Biết: Ba = 137, Na = 23, K = 39, Fe = 56, C = 12, H =1, O= 16, S = 32, Cl =35,5, Mg =24, Al =27; Zn = 65, Cu = 64
Phần 1. Trắc nghiệm khách quan
Câu 1. Có 4 ống nghiệm đựng các dung dịch: Ba(NO3)2, KOH, HCl, (NH4)2CO3. Dùng thêm hóa chất nào sau đây để nhận biết được chúng?
A. Quỳ tím
B. Dung dịch phenolphtalein
C. CO2
D. Dung dịch Na
OH
Câu 2. Cho các chất: Mg
O, Mg(OH)2, Mg
CO3 và Mg. Chất nào sau đây phản ứng được với cả 4 chất trên?
A. H2O
B. HCl
C. Na2O
D. CO2
Câu 3. Dung dịch KOH phản ứng với dãy oxit:
A. CO2; SO2; P2O5; Fe2O3
B. Fe2O3; SO2; SO3; Mg
O
C. P2O5; CO2; Al2O3; SO3
D. P2O5; CO2; Cu
O; SO3
Câu 4. Cho 200ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Khối lượng kết tủa thu được là:
A. 17,645 gam
B. 16,475 gam
C. 17,475 gam
D. 18,645 gam
Câu 5. Phát biểu nào dưới đây sai?
A. Kim loại Vonfram được dùng làm dây tóc bóng đèn điện là do có nhiệt độ sôi cao.
B. Bạc, vàng được dùng làm đồ trang sức vì có ánh kim, bề mặt rất đẹp.
C. Nhôm được dùng làm vật liệu chế tạo vỏ máy bay là do bền và nhẹ.
D. Đồng và nhôm được dùng làm dây điện là do dẫn điện tốt.
Câu 6. Dãy nào dưới đây được sắp xếp theo thứ tự tăng dần mức độ hoạt động hóa học
A. Na, Al, Cu, Zn
B. Cu, Al, Zn, Na
C. Na, Al, Zn, Cu
D. Cu, Zn, Al, Na
Câu 7. Để phân biệt 3 gói bột: Fe, Cu và Al có thể dùng các dung dịch
A. Na
OH và Fe
Cl2
B. HCl và Cu
Cl2
C. Ca(OH)2 và Na
Cl
D. HCl và Na
OH
Câu 8. Phát biểu nào sau đây không đúng?
A. Khi cho sắt tác dụng với dung dịch HCl tạo thành muối và Fe
Cl2
B. Khi cho clo tác dụng với sắt tạo thành muối Fe
Cl3
C. Khi cho clo tác dụng với sắt tạo thành muối Fe
Cl2
D. Khi cho clo tác dụng với Fe
Cl2 tạo thành muối Fe
Cl3
Câu 9. Cho phản ứng hóa học sau:
Na
Cl + H2O → X + H2 + Cl2 (có màng ngăn)
X là:
A. Na
B. Na
OH
C. Na2O
D. Na
Cl
O
Câu 10. Khí CO tác dụng được với tất cả các chất nào dưới đây?
A. Fe2O3, Cu
O, O2, Pb
O
B. Cu
O, Ca
O, C, O2
C. Al2O3, C, O2, Pb
O
D. Fe2O3, Al2O3, Ca
O, O2
Phần 2. Tự luận (7 điểm)
Câu 1. Hoàn thành các phản ứng hóa học sau:
1) Na
HCO3 + HCl →
2) Fe3O4 + CO →
3) Al + Ag
NO3 →
4) Si
O2 + Na
OH →
5) Fe
Cl3 + KOH →
Câu 2. Bằng phương pháp hoá học hãy nhận biết các dung dịch riêng biệt sau: HCl, Na
OH, Na2SO4, Na
Cl.
Câu 3. Dẫn toàn bộ 19,15 gam hỗn hợp X gồm Pb
O và Cu
O bằng V lít khí CO (đktc) ở nhiệt độ cao. Khí sinh ra sau phản ứng được dẫn vào bình đựng dung dịch Ca(OH)2 dư thu được 15 gam kết tủa.
a) Viết phương trình hóa học phản ứng xảy ra.
Xem thêm: Top 10 gọng kính nhựa trong suốt cao cấp, giá sốc, ship cod tận nhà
b) Tính thể tính khí CO (đktc)
c) Tính khối lượng của mỗi chất ban đầu trong hỗn hợp X.
(Cho biết: Ag = 108; Ca = 40; H = 1; Cu = 64; S = 32; O = 16, Pb = 207, Fe = 56)